|  |  |  |  |
ATOMENS MILSTOLPAR
 |  |
Kunskapen om atomen och dess delar är knappt 200 år gammal. Atomen är ett aktuellt forskningsområde och viktiga upptäckter görs bland annat på Cern i Schweiz, ett berömt forskningscentrum för partikelfysik. Cern upptäckte bland annat, Higgspartikeln vilket ledde till nobelpris i fysik år 2013. Bilden nedan visar partikelacceleratorn i Cern.
Bild: Robert Kravos / UgglansNO
De första stegen mot en modern atomteori togs av John Dalton i början av 1800-talet. Han antog att grundämnen har atomer som är lika d.v.s. har samma vikt och kemiska egenskaper. Dalton genomförde många experiment där han studerade viktförhållanden mellan grundämnen, i olika kemiska reaktioner. Han kom bland annat fram till att det går åt åtta gram syre och ett gram väte för att bilda vatten. Daltons teorier ersatte antikens lära om de fyra elementen (eld, jord, luft och vatten). Dock trodde han att atomen var odelbar vilket är felaktigt.
I slutet av 1800-talet började vetenskapen använda elektronen som begrepp, troligtvis eftersom den användes inom den nya vetenskapen elektricitet. En teori var att elektronerna fanns i atomen likt russinen i en russinkaka. Vetenskapen uppfattade i och med detta att atomen inte var en enhet utan att den bestod av olika delar.
I början av 1900-talet gjordes ett numera klassiskt experiment som var avgörande för atomfysiken. Den engelske fysikern Ernest Rutherford lät sina studenter skjuta heliumkärnor mot en tunn guldfolie. De flesta heliumkärnor for rakt igenom guldfolien men några studsade tillbaka. Rutherford drog slutsatsen att atomen har en positiv kärna som heliumkärnorna studsade mot men att det var mest tomrum i atomen. Elektronerna antog han for runt atomkärnan likt planeterna far runt solen i solsystemet.
Dansken Niels Bohr förbättrade denna atommodell genom förslaget att elektronerna rörde sig i olika energinivåer runt atomkärnan. Genom denna teori förkastade han den gamla fysiken och införde en helt ny, kvantfysiken. Bohrs teorier och atommodell används fortfarande.
Protonen upptäcktes år 1918 och neutronen år 1932. Under 1900-talet upptäcktes många fler partiklar som nu ingår i standardmodellen. Det är fysikernas försök att göra en heltäckande teori om hur alla naturkrafter och partiklar påverkar varandra.
Fördjupning:
- Hemsida – Om världens största partikelaccelerator. (home.cern)
- Film – John Daltons atomic theori (HumenGulaman, engelska, 2.56)
- Film – John Dalton biography (Cloudbiography, engelska, 1.56)
- Hemsida – De fyra elementen (ditthoroskop.nu)
- Film – The discovery of the atomic nucleus. (Science and Technology, engelska, 3,27)
Övningar:
ATOMKUNSKAP
 |  |
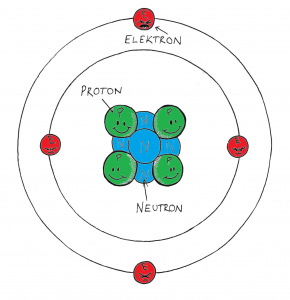
Bild: Pontus Wallstedt / UgglansNO
Atomen består av en kärna med protoner (positivt laddade) och neutroner (neutralt laddade). Runt atomkärnan finns elektroner (negativt laddade) i olika elektronskal. Antalet protoner bestämmer vilket grundämne det är. Elektronerna i det yttersta elektronskalet (valenselektroner) bestämmer grundämnets egenskaper.
Bild: Clker-Free-Vector-Images / Pixabay License
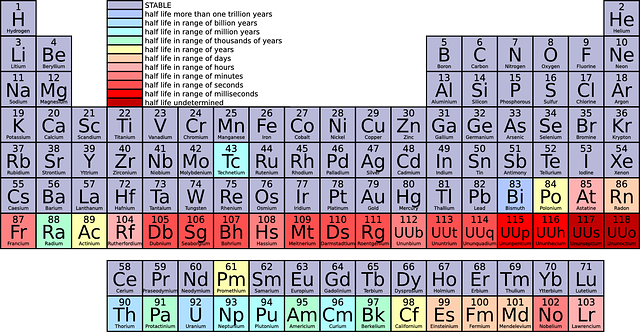
I det periodiska systemet finns alla grundämnen som är kända idag. Som grundämne, uppställt i periodiska systemet, har det alltid lika många elektroner som protoner. Ett grundämne är alltså oladdat. Grundämnen eftersträvar fullt yttre elektronskal. Därför ger/tar eller lånar de elektroner med andra atomer. Om en atom inte har lika många protoner (positiva laddningar) som elektroner (negativa laddningar) kallas den jon. En atom blir en positiv jon om den har förlorat elektroner och en negativ jon om den har tagit upp elektroner.

Bild: Oskar Uggla / UgglansNO
Elektronskal är de energinivåer som elektronerna färdas i. Skalen börjar namnges från atomkärnan med bokstaven K. K-skalet kan max innehålla två elektroner, L-skalet åtta. Det yttersta elektronskalet kan max innehålla åtta elektroner oavsett vilken bokstav det har (undantag om det är K-skalet).
Sammanfattning: Antalet protoner avgör vilket grundämne det är. Antalet elektroner bestämmer om grundämnet är en jon (laddat) eller oladdat. Antalet neutroner avgör vilken isotop av grundämnet det är. En isotop är en variant av ett grundämne. Alla grundämnen har isotoper. Isotoperna av ett grundämne får olika egenskaper. Framförallt avgör det om ämnet är radioaktivt eller inte.
Fördjupning:
- Film – Atomen (Andreas Sandqvist, 9.58, Svenska)
- Film – Atomens byggnad (Bertram Stenlund, Svenska, 5,04)
- Hemsida – Det periodiska systemet (naturvetenskap.org)
- Hemsida – Joner (naturvetenskap.org)
- Film – Atoms explained (Kurzgesagt, 4.58, Engelska)
- Film – Niels Bohr (Urplay, 18.00, svenska)
Uppgifter:
ISOTOPER
 |  |
Isotop
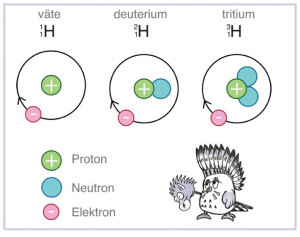
Bild: PontusWallstedt / UgglansNO
Ett grundämne kan ha olika antal neutroner. Det innebär att det finns olika varianter av ett och samma grundämne. Dessa varianter kallas isotoper. På bilden ovan ser vi grundämnet vätes tre isotoper.
Varje grundämne har isotoper naturligt. Isotoperna får olika egenskaper. Till exempel kan de bli radioaktiva. Det innebär att atomkärnan blir instabil och faller sönder.
Atomnummer och masstal
Med det kemiska tecknet för ett grundämne går det att visa information om grundämnet. Varje hörn runt det kemiska tecknet nedan visar en speciell information.
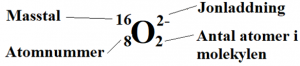
Siffran nere till vänster kallas atomnummer. Atomnumret visar vilket grundämne det är och hur många protoner grundämnet har i atomkärnan. Masstal är antalet partiklar i atomkärnan. Det är samma sak som antalet protoner + antalet neutroner. Högst upp till höger visas jonladdningen. Den visar om grundämnet gett eller tagit upp elektroner. Siffran längst ner till höger visar antalet atomer i molekylen. I detta fall två stycken.
I atomfysiken används huvudsakligen kunskapen om grundämnets masstal och atomnummer. I exempel 1 har vätet dessa antal av respektive partikel:

- Protoner = Atomnummer = 1
- Neutroner = Masstal -atomnummer = 3-1 = 2
- Elektroner = protoner (i ett oladdat grundämne) = 1
Exempel två är svårare. Testa själv!
Atommassa och formelmassa
En atom har en massa. Eftersom massan är extremt liten är det svårt att använda kg som enhet. Istället används enheten ”unit”. Proton väger ungefär en unit. En neutron väger också ungefär en unit. Elektronen väger 2000 gånger mindre så den brukar inte tas med i beräkningarna. Atomen har atomvikt och kemiska föreningar har formelmassa. När du räknar ut formelmassan adderar du varje atoms atomvikt
ex 1. Vatten H2O: Syre har atomvikten 16 u och väte 1 u. Vattnets kemiska formel är H2O. Formelmassan är: 1+1+16 = 18 unit
ex 2. Metan CH4. Kol har atomvikten 12 u och väte 1 u. Formelmassan är = 12+1+1+1+1= 16 unit
Fördjupning:
- Hemsida – isotoper (naturvetenskap.org)
- Film – Atomkärnan och isotoper (Bertram Stenlund, svenska, 5,31)
- Film – Crash Course Chemistry #1 (Crashcourse, engelska, 10.11)
- Film – What are isotopes? (Fuseschool, engelska, 2.50)
- Film – What are radioaktive isotopes? (Fuseschool, engelska, 4.29)
Uppgifter:
LJUSEMMISION
 |  |
Atomer kan avge ljus. Det inträffar när energi tillförs till atomen till exempel om ett ämne värms upp väldigt mycket.
Elektronerna i en atom är ordnade i elektronskal. Elektronskalet närmast atomkärnan kallas K-skalet. Därefter följer man alfabetet. Nästa skal kallas alltså L-skalet o.s.v. De grundämnen med flest elektroner (period 7) har Q-skal.
Elektronskalen är egentligen energinivåer. Elektroner med en viss energi befinner sig i ett givet elektronskal.
När ett ämne värms upp tillförs energi till elektronerna. Elektronerna byter då till ett elektronskal längre bort från atomkärnan, de exciteras vilket har en högre energinivå. Eftersom elektroner helst vill vara på sin vanliga plats hoppar de sedan tillbaka.
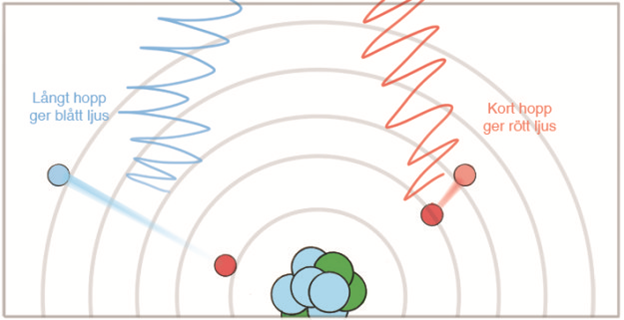
Bild: PontusWallstedt / UgglansNO
För att elektronen ska hoppa måste den tillföras energi. När elektronen hoppar tillbaka sänder den ut överskottsenergin som en ljuspartikel (foton).
En foton är en energipartikel. Fotoner kan ha olika mycket energi beroende på vilken våglängd den har. Beroende på hur korta eller långa elektronhoppen är sänds fotoner med olika våglängd ut. En del av dessa våglängder ger infrarött ljus, en del ger synligt ljus. Långa elektronhopp ger ultraviolett ljus.

Bild: OskarUggla / UgglansNO
Varje grundämne har sina elektroner fördelade i skalen på ett unikt sätt. Eftersom elektronhoppen beror på denna fördelning kommer varje grundämne att sända ut ljus på ett unikt sätt. Ljuset undersöks i ett spektroskop. Där syns flera linjer med olika våglängder, likt ett fingeravtryck, som kallas linjespektrum.
Kunskapen kring spektrallinjer är viktigt inom astronomin. Genom att analysera elektromagnetisk strålning från himlakroppar med teleskop har mänskligheten fått bättre förståelse för universums uppbyggnad.
BIld: PontusWallstedt / UgglansNO
Fördjupning:
- Hemsida – Röntgen (Tekniska museet)
- Film: Elektromagnetiska vågor (Bertram Stenlund, svenska, 4,01)
- Artikel – Skiktröntgen (1177.se)
- Film – Mobilstrålning (Urplay, 1.56, svenska)
- Film – How do microwaves work? (Chem-matters, 5.28, engelska)
- Film – What are x-rays (GRS, 3.58, engelska)
Uppgifter:
ELEKTROMAGNETISK STRÅLNING
 |  |
 Bild: Pontus Wallstedt / UgglansNO
Bild: Pontus Wallstedt / UgglansNO
Fotoner kan ha olika mycket energi. Ju högre energi desto kortare våglängd. Människor kan bara se synligt ljus, då detta ljus har en våglängd vi kan se. Här nedan är andra typer av ljus: De med längst våglängd kommer först.
Radiovågor – Används för att skicka olika typer av signaler. Radio och TV fungerar med hjälp av radiovågor. En militär uppfinning, radar, använder radiovågor.
Mikrovågor – Mikrovågor har liknande användningsområden som radiovågor men används även i mobiler, mikrovågsugnar och GPS:er.
Infraröd strålning – Kallas också värmestrålning. Genom att mäta värmestrålning går det att se om hus läcker energi. Kan också finnas i fjärrkontroller. En IR-kamera känner av infraröd strålning och kan skapa bilder av föremål, som sänder ut värme, trots att det är mörkt.
Synligt ljus eller vitt ljus består av många färger. Det är dessa våglängder som människor kan se.
Ultraviolett strålning – Det ultravioletta ljuset gör oss solbrända. Vårt pigment i huden ändrar färg för att skydda oss från solen som bland annat sänder ut UV-ljus. Ultraviolett ljus kan inte passera genom glas. Det går därför inte att sola genom en glasruta. Ultraviolett strålning används också för att se om sedlar är äkta. En del ämnen tar upp UV-ljus och sänder ut det som vanligt vitt ljus. På dansgolvet på ett diskotek kan du ibland se att dina tänder blivit extra vita. Om du tvättat dina kläder med tvättmedel som innehåller optiskt vitmedel kommer det ämnet omvandla UV-ljus till synligt ljus. Din t-shirt kommer lysa i mörkret om den belyses med UV-ljus.
Röntgenstrålning – Används på sjukhus för att se hur skelettet ser ut. Handens mjuka delar släpper igenom mer strålning än skelettet. Därför syns skelettet på bilden.
Gammastrålning – Denna strålning innehåller extremt mycket energi och är direkt farlig. Den bildas vid händelser i rymden till exempel gammablixtar eller vid sönderfall av radioaktiva ämnen som i atombomber.

Bild: Pontus Wallstedt / UgglansNO
Fördjupning:
- Hemsida – Röntgen (Tekniska museet)
- Film: Elektromagnetiska vågor (Bertram Stenlund, svenska, 4,01)
- Artikel – Skiktröntgen (1177.se)
- Film – Mobilstrålning (Urplay, 1.56, svenska)
- Film – How do microwaves work? (Chem-matters, 5.28, engelska)
- Film – What are x-rays (GRS, 3.58, engelska)
Uppgifter:
RADIOAKTIVITET
 |  |
Radioaktivitet.
Radioaktivitet upptäcktes i slutet av 1800-talet av Henry Becquerel. Marie Curie är också ett av de stora namnen inom upptäckterna kring radioaktivitet. Dessa två fick dela på nobelpriset 1903 i fysik för sina upptäckter.
Radioaktivitet kallas den process då atomkärnan spontant sönderfaller och avger strålning. Det beror på att atomkärnan innehåller för mycket energi för att den ska vara stabil. Dessa atomer kallas instabila eller radioaktiva. Alla grundämnen över atomnummer 82 är instabila, men de flesta andra grundämnen har någon isotop som är radioaktiv.
Joniserande strålning.
Strålning som slår bort elektroner från atomerna den passerar så att joner bildas, kallas joniserande. Den joniserande strålningen kan komma från:
1. Partikelstrålning: Ämnen vars atomkärnor faller sönder och då sänder ut partiklar. Denna strålning kallas alfastrålning eller betastrålning. Betastrålningen kan vara negativ eller positiv, men vanligtvis tas enbart den negativa upp i grundläggande atomfysik.
2. Elektromagnetisk strålning: den elektromagnetiska strålningen med allra högst energi, röntgenstrålning och gammastrålning, är joniserande.
Att mäta strålning:
Bild: olafpictures /Pixabay License
Aktivitet: mäter hur många sönderfall som sker per sekund. Mäts i Bequerel (Bq) efter fysikern som upptäckte den naturliga radioaktiviteten. För att visa på radioaktivitet i filmer och dataspel brukar det finnas med en apparat som knäpper t.ex. dataspelet Fallout. Det som då används är ett Geiger-Muller-rör (GM-rör).
Stråldos: mäter hur mycket energi en kropp (som utsätts för strålning) tar upp per kilo. En människa bör inte få för hög stråldos. Därför har personer som jobbar i närheten av strålning en mätare på sig (persondosimeter) som registrerar hur mycket strålning en kropp mottagit under en viss tid. Enhet för stråldos är Sievert (Sv).
Gray är också en enhet för radioaktivitet. Den anger absorberad (upptagen) dos av joniserande strålning. Gray fungerar även på icke organiskt material det vill säga ämnen som inte innehåller kol.
Bild: OpenClipart-Vectors / Pixabay License
Fördjupning:
- Film – Radioaktivitet (Andreas Sandqvist, 9.49, Svenska)
- Hemsida – Joniserande strålning (Strålskyddsmyndigheten)
- Hemsida – Vad är joniserande strålning (slutförvarforsmark.se)
- Film –: The most radioactive places on earth? (Veritasium, engelska, 11.17)
- Film – The genius of Marie Curie (Ted-Ed, 5.04, Engelska)
- Film – Marie Curie (Urplay, 18.00, svenska)
- Film – What is radioactivity (GRS, 3.31, engelska)
Uppgifter:
ALFA BETA GAMMA
 |  |
Dessa är de tre vanligaste typerna av strålning:
Alfastrålning
Förändring av atomen:
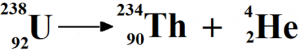
Bilden ovan visar grundämnet uran som avger alfastrålning. På detta sätt skrivs i regel sönderfall. Startämnet till vänster med masstal och atomnummer utskrivet. Resultatet av sönderfallet är att grundämnet thorium (Th) skapas eftersom antalet protoner förändras. Det bildas också alfapartiklar. Adderar du masstalen på den högra sidan om pilen ser du att det stämmer med den vänstra.
Betastrålning:
Förändring av atomen:
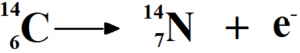
Vid betastrålning (β-) omvandlas en neutron till en proton och sedan sänds en elektron ut. Den innebär att atomnumret ändras och att det blir ett nytt ämne
Gammastrålning:
Förändring av atomen:
Ingen förutom att atomkärnan förlorar energi.
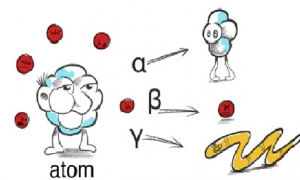
Bild: Pontus Wallstedt / UgglansNO
Fördjupning:
- Film – Strålning (Andreas Sandqvist, 5.25, Svenska)
- Film: Radioaktivitet(Bertram Stenlund, svenska, 5.59)
- Film: Radioaktivt sönderfall (Bertram Stenlund, svenska, 4.19)
- Film – What is Alpha, beta och gamma radiation? (GRS, 2.16, engelska)
- Film – Types of radiation (Fuseschool, Engelska, 3.16)
Uppgifter:
HALVERINGSTID
 |  |
Sönderfall sker slumpmässigt så det är omöjligt att förutsäga när en enskild radioaktiv atomkärna ska sönderfalla.
Ett radioaktivt grundämne sönderfaller i en hastighet som är unik för just den isotopen. Begreppet halveringstid används för att kunna jämföra hastigheten i olika sönderfall. Halveringstid mäter hur lång tid det tar för att hälften av ett ursprungligt ämne ska sönderfalla. Till exempel har uran halveringstiden 4,5 miljarder år. Har du 1 kg uran nu så har du bara 0.5 kg uran kvar efter denna tidsperiod. Vart har resten tagit vägen? Jo, det har omvandlats till thorium på grund av uranets alfastrålning. Väntar du 4,5 miljarder år till finns bara 25 procent av det ursprungliga uranet kvar.
Vid gammastrålning innebär halveringstiden att hälften av aktiviteten (strålningen) har försvunnit. Nedan är en bild på radiums (Ra) sönderfall.
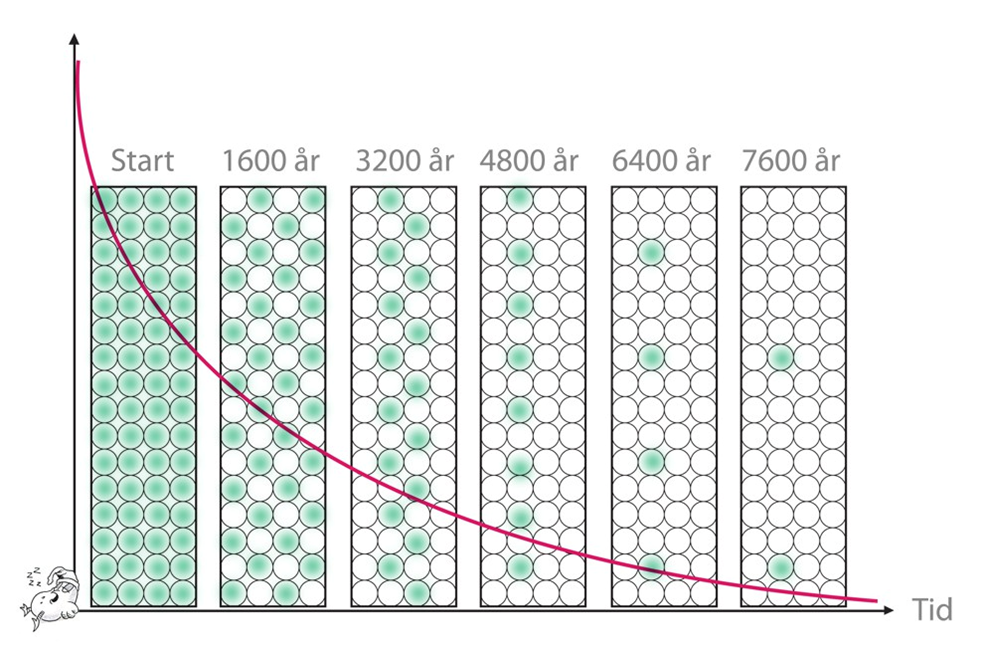
Bild: Pontus Wallstedt / UgglansNO
Observera att radiumet inte försvinner bort i tomma luften. Det omvandlas till radon. 1 kg radium kommer efter 10 000 år fortfarande väga ungefär 1 kg.
Kol 14 – metoden:
Grundämnet kol har en användbar radioaktiv isotop med masstalet 14 (sex protoner och åtta neutroner). Kol-14 har en halveringstid på 5730 år och används för att bestämma åldern på organiska (innehåller kol) föremål som är upp till 50 000 år gamla. Efter 50 000 år har det mesta av kol-14 sönderfallit och är omöjligt att mäta.
Bild: simonatova / Pixabay
När en organism lever så lagrar den kol i kroppen. Detta gäller både djur och växter. I atmosfären har det mesta kolet (i koldioxid) masstalet 12. En liten del av kolet är det radioaktiva kol-14. När organismen lever tar den upp kol, men när den dör så gör den naturligtvis inte det. Då börjar sönderfallet av det kol-14 som organismen tagit upp. Genom att jämföra halten av kol-12 med kol-14 i föremålet som undersöks, kan det åldersbestämmas.
Sönderfallsserier:
Många radioaktiva grundämnen sönderfaller till något, som i sin tur också är radioaktivt och sönderfaller. Ett ursprungligt radioaktivt grundämne kan sönderfalla i många led tills det bildas en stabil isotop. Dessa förlopp sammanställs i tabeller som kallas sönderfallsserier.
Fördjupning:
- Film: Halveringstid och aktivitet (Bertram Stenlund, svenska, 5,09)
- Film – Kol-14 (Matematik och naturvetenskap, 8.52, svenska)
- Film – How does radiocarbon dating work? (Scientific American, engelska, 2.10)
- Film – Carbon12, Carbon13, Carbon14 (Atomivschool, engelska, 6.39)
Uppgifter:
NYTTIG STRÅLNING
 |  |
Vi utsätts hela tiden för strålning. Strålning som orsakas av naturlig aktivitet kallas bakgrundsstrålning. Denna kommer från:
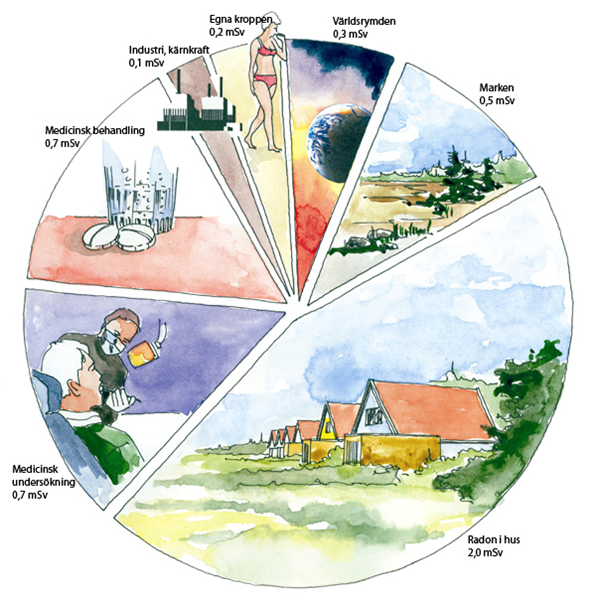
Bild: OKG Aktiebolag (med tillstånd)
- Kosmisk strålning: Radioaktiva partiklar som kommer från rymden. Kabinpersonal på flygplan (som är närmare rymden) får dubbelt så hög dos som folk nere på jorden.
- Strålning från marken: I berggrunden finns radioaktiva isotoper som sänder ut gammastrålning. Denna strålning varierar mycket beroende på var i världen du befinner dig.
- Sönderfall inuti kroppen: I kroppen finns radioaktiva isotoper främst kol-14 och kalium-40 som ger en viss strålning.
- I vissa hus är det problem med radon. Det är en radioaktiv gas som finns antingen i berggrunden under huset eller i husets byggnadsmaterial.
- Medicinsk användning: Om du röntgar dig hos en läkare eller tandläkare får du en dos radioaktiv strålning.
När används radioaktivitet till något bra?
Röntgen – I röntgenstrålning och vid skiktröntgen används joniserande strålning för att undersöka skelettet. Röntgenstrålningen passerar genom kroppens mjuka delar, men inte genom de hårda skelettbenen. I en dator visas sedan en bild på skelettet och läkare kan avgöra vad som hänt.
 Bild: Pigsels / Creative Commons Zero – CC0
Bild: Pigsels / Creative Commons Zero – CC0
Cancerbehandling – Betastrålning används för att stråla och därigenom döda cancertumörer. Cancercellerna är lite svagare än de vanliga cellerna så de dör först vid behandling. De vanliga cellerna tar också stryk vilket gör att det är oerhört tufft att gå igenom denna cancerbehandling. Betastrålning är också i sig cancerframkallande så beroende på din ålder hanteras denna behandling olika. Inom cancervården används också radioaktiv märkning för att spåra cancertumörer.
Livsmedel – Genom att bestråla livsmedel ökar hållbarheten. Tanken är att döda främmande celler (insekter, larver och bakterier) samt förhindra att potatis och lök får groddar.
Åldersbestämning – Kol 14 – metoden används flitigt för att åldersbestämma föremål som innehåller kol och som är yngre än 50 000 år.
Kärnkraft är en viktig energikälla i många av världens länder, bland annat i Sverige.
Fördjupning:
- Film – Vad är joniserande strålning? (KSUinformation, svenska, 2.40)
- Hemsida – Strålning (miljo.vgy.se)
- Artikel – Radioaktivitet som hälsokälla. (SVT nyheter)
- Hemsida – Strålningen du utsätts för dagligen – så farlig är den. (M3.se)
- Film – Hur röntgen ser genom din hud (Ted-Ed, 4.42, Engelska)
- Film – Radiation in aeroplanes (GRS, 2.22, engelska)
Uppgifter:
FAROR MED RADIOAKTIVITET
 |  |
Faror med radioaktivitet.
Radioaktivitet kan användas för militärt bruk i atombomber och vätebomber, men även smutsiga bomber. En smutsig bomb är en vanlig bomb som kombineras med ett radioaktivt ämne. Tanken är att förorena ett område så att civilbefolkningen inte kan bo kvar där.
Vid kärnkraftsolyckor sprids radioaktivt avfall. Områdena kring olycksplatsen blir kontaminerade (förorenade) och människor får inte vistas i närheten. Kring Tjernobyl (Ukraina) finns ett sådant område och ett annat finns i Fukushima (Japan).
Bild: AlexAntropov86 / Pixabay
Hur påverkas människor av strålning?
Radioaktivitet, med sin joniserande strålning, kan vara cancerframkallande. Strålningen bryter sönder DNA-molekylen och när den repareras kan det uppstå mutationer.
Att få en hög stråldos är direkt dödligt. Alla de partiklar som skjuter igenom kroppen orsakar inre blödningar och skadar tarmar och nervsystem. Den som drabbas av riktigt hög strålning dör inom ett par minuter till något dygn.
Medelhöga stråldoser, som inte är direkt dödliga, påverkar de av kroppens celler som har hög celldelningstakt. Till exempel benmärgens celler eller celler i matspjälkningsorganens slemhinnor. Oftast leder denna strålning till cancer i dessa delar av kroppen. Leukemi (blodcancer) är vanligt.
När det gäller låga stråldoser är det svårare att avgöra hur farliga dessa är. Det är inte enkelt att experimentera med människor. Däremot har forskare försökt undersöka vad som hände med människor efter andra världskrigets atombomber och efter kärnkraftsolyckan i Tjernobyl där många människor utsattes för låga stråldoser.
Sammantaget verkar det som att människor, djur och växter klarar låga stråldoser bra. Efter Tjernobyl ökar cancerfallen med ett extra dödsfall för varje miljon invånare och år. Det verkar också vara låg risk för långsiktiga genetiska skador. Det har alltså inte dykt upp några unika mutationer efter det att organismer har utsatts för strålning.
Anledningen till de låga dödstalen tros vara att många arter har ett naturligt skydd mot strålning. Strålningen ger upphov till att det bildas joner i kroppen som i sin tur sätter igång oönskade kemiska reaktioner. Dessa joner kallas för fria radikaler. Kroppens försvar mot fria radikaler är att skapa antioxidanter, vilka fungerar som ett motmedel. När strålningen ökar kan kroppen skapa mer antioxidanter som neutraliserar hotet. Vissa djur, till exempel flyttfåglar, har låga halter av antioxidanter och verkar inte klara låga stråldoser speciellt bra.
Foto: Free-Photos / Pixaba
Fördjupning:
- Film – Spökstaden – Reser till Tjernobyl (Henrik Giljam Rapp, svenska 23.08)
- Film – Understanding the accident of Fukushima (IRSN, engelska, 13.01)
- Film – Unimaginable nuclear meltdown in Fukushima. (David Pugliese, engelska, 11.29)
- Film – Can you survive nuclear fallout? (Ted-Ed, 5.25, Engelska)
- Film – Is radiation dangerous? (Ted-Ed, 5.21, Engelska)
- Film – Expect the unexpected (Ted-Ed, 4.15, Engelska)
- Film – What is a dosimeter? (GRS, 2.20, engelska)
- Film – What is radon? (GRS, 2.11, engelska)
Uppgifter:
KÄRNENERGI
 |  |
Albert Einstein påstod, i början av 1900-talet, att materia är en form av energi. Han ställde upp sambandet i världens kanske mest kända formel: E = m*c2(m = massa och c = ljusets hastighet). Om de starka krafter som håller ihop atomens smådelar kunde frigöras skulle det ge ofantliga mängder energi. Denna teori var vetenskapen ännu inte redo att testa men 1932 upptäcktes neutronen och lite senare hittade vetenskapsmän lämpliga grundämnen att klyva, uran-235 och plutonium-239
Den som löste kärnklyvningens gåta var Lise Meitner som tolkade Otto Hahns resultat efter hans experiment. Hon lanserade hypotesen att kärnklyvning uppstår då uran utsätts för neutronbestrålning. Lise var judinna som flydde undan nazisterna och gjorde sina upptäckter i Sverige. Otto Hahn fick nobelpris i kemi 1944 men inte hon. Hon har fått namnge ett grundämne, Meitnerium (nr. 109).
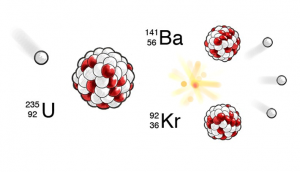
Bild: Pontus Wallstedt / UgglansNO
När uran-235 bestrålas med neutroner kommer urankärnan att splittras till mindre atomkärnor.
När en neutron tillförs till urankärnan får kärnan för mycket energi och börjar vibrera. Vibrationerna leder till att kärnan splittras. Antalet protoner och neutroner är likadant före som efter denna händelse. Adderas de ämnen som uppstått efter klyvningen väger de mindre än ämnet som ursprungligen fanns. Den försvunna massan har omvandlats till energi.
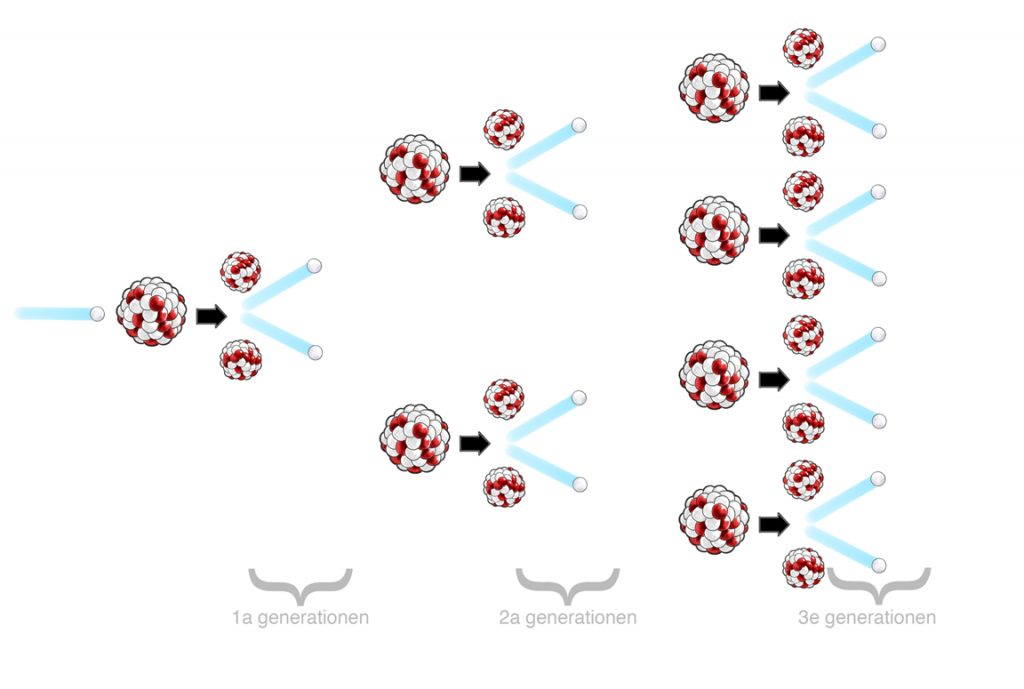
Bild: Pontus Wallstedt / UgglansNO
Vid kärnklyvningen frigörs också ett antal fria neutroner som i sin tur klyver andra uranatomer. Det blir en kedjereaktion.
Om denna kedjereaktion får fortsätta bildas till slut extremt mycket ljus, värme och joniserande strålning. En atombomb är en kedjereaktion som inte begränsas. Efter andra världskriget började man använda denna energiresurs under kontrollerade former i kärnkraftverk. Att utnyttja kärnenergi på detta sätt kallas fission.
Fusion kallas den motsatta processen, då lätta atomkärnor sätts ihop till större. Det krävs extremt högt tryck och temperatur för att detta ska kunna ske. Fusion sker bland annat i solen. Bilden visar två olika isotoper av väte som bildar helium, en fri neutron samt energi.
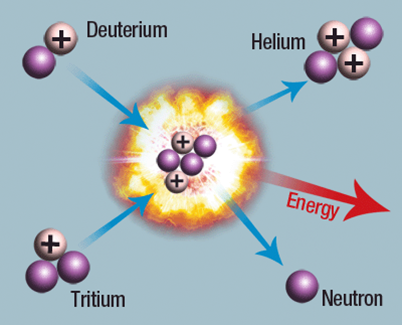
Bild: Haasrm / Creative Commons Attribution-Share Alike 3.0 Unported
Fördjupning:
- Film – Kärnenergi (Andreas Sandqvist, 9.58, Svenska)
- Film – Lise Meitner – Atombombens moder (Film och skola, svenska, 1.55)
- Film – Nuclear death (Kurzgesagt, 10.40, Engelska)
- Film – Vad händer om vi atombombar en stad? (Kurzgesagt, 8.56, Engelska)
- Film – Fusion energy (Kurzgesagt, 6.16, Engelska)
- Film – Kärnkraft är fruktansvärt (Kurzgesagt, 4.10, Engelska)
- Film – 3 anledningar varför kärnkraft är bra (Kurzgesagt, 4.21, Engelska)
- Film – Nuclear energy (Kurzgesagt, 5.18, Engelska)
- Film – Fusionskraft (Urplay, 9.00, svenska)
- Film – Nuclear fission och nuclear fusion (GRS, 5.53, engelska)
Uppgifter:
 |  |  |  |  |