 |  |
Isotop
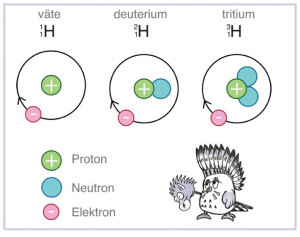
Bild: PontusWallstedt / UgglansNO
Ett grundämne kan ha olika antal neutroner. Det innebär att det finns olika varianter av ett och samma grundämne. Dessa varianter kallas isotoper. På bilden ovan ser vi grundämnet vätes tre isotoper.
Varje grundämne har isotoper naturligt. Isotoperna får olika egenskaper. Till exempel kan de bli radioaktiva. Det innebär att atomkärnan blir instabil och faller sönder.
Atomnummer och masstal
Med det kemiska tecknet för ett grundämne går det att visa information om grundämnet. Varje hörn runt det kemiska tecknet nedan visar en speciell information.
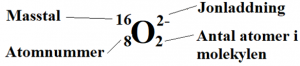
Siffran nere till vänster kallas atomnummer. Atomnumret visar vilket grundämne det är och hur många protoner grundämnet har i atomkärnan. Masstal är antalet partiklar i atomkärnan. Det är samma sak som antalet protoner + antalet neutroner. Högst upp till höger visas jonladdningen. Den visar om grundämnet gett eller tagit upp elektroner. Siffran längst ner till höger visar antalet atomer i molekylen. I detta fall två stycken.
I atomfysiken används huvudsakligen kunskapen om grundämnets masstal och atomnummer. I exempel 1 har vätet dessa antal av respektive partikel:

- Protoner = Atomnummer = 1
- Neutroner = Masstal -atomnummer = 3-1 = 2
- Elektroner = protoner (i ett oladdat grundämne) = 1
Exempel två är svårare. Testa själv!
Atommassa och formelmassa
En atom har en massa. Eftersom massan är extremt liten är det svårt att använda kg som enhet. Istället används enheten ”unit”. Proton väger ungefär en unit. En neutron väger också ungefär en unit. Elektronen väger 2000 gånger mindre så den brukar inte tas med i beräkningarna. Atomen har atomvikt och kemiska föreningar har formelmassa. När du räknar ut formelmassan adderar du varje atoms atomvikt
ex 1. Vatten H2O: Syre har atomvikten 16 u och väte 1 u. Vattnets kemiska formel är H2O. Formelmassan är: 1+1+16 = 18 unit
ex 2. Metan CH4. Kol har atomvikten 12 u och väte 1 u. Formelmassan är = 12+1+1+1+1= 16 unit
Fördjupning:
- Hemsida – isotoper (naturvetenskap.org)
- Film – Atomkärnan och isotoper (Bertram Stenlund, svenska, 5,31)
- Film – Crash Course Chemistry #1 (Crashcourse, engelska, 10.11)
- Film – What are isotopes? (Fuseschool, engelska, 2.50)
- Film – What are radioaktive isotopes? (Fuseschool, engelska, 4.29)
Uppgifter:
| Hela kursen: | Kursens begrepp: | Kursens test: |
| Atomfysik | Quizlet – Tabs | Deltest – Stortest |
Hjälp till att förbättra Ugglans NO! Har du hittat något fel, någon död/olämplig länk eller vill tipsa om någon intressant länk? Skriv en kommentar nedan!

