 |  |
Atomer kan avge ljus. Det inträffar när energi tillförs till atomen till exempel om ett ämne värms upp väldigt mycket.
Elektronerna i en atom är ordnade i elektronskal. Elektronskalet närmast atomkärnan kallas K-skalet. Därefter följer man alfabetet. Nästa skal kallas alltså L-skalet o.s.v. De grundämnen med flest elektroner (period 7) har Q-skal.
Elektronskalen är egentligen energinivåer. Elektroner med en viss energi befinner sig i ett givet elektronskal.
När ett ämne värms upp tillförs energi till elektronerna. Elektronerna byter då till ett elektronskal längre bort från atomkärnan, de exciteras vilket har en högre energinivå. Eftersom elektroner helst vill vara på sin vanliga plats hoppar de sedan tillbaka.
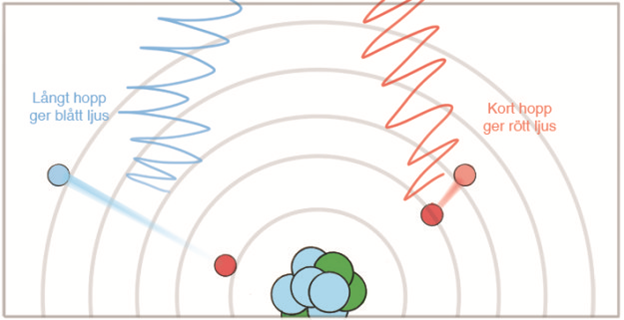
Bild: PontusWallstedt / UgglansNO
För att elektronen ska hoppa måste den tillföras energi. När elektronen hoppar tillbaka sänder den ut överskottsenergin som en ljuspartikel (foton).
En foton är en energipartikel. Fotoner kan ha olika mycket energi beroende på vilken våglängd den har. Beroende på hur korta eller långa elektronhoppen är sänds fotoner med olika våglängd ut. En del av dessa våglängder ger infrarött ljus, en del ger synligt ljus. Långa elektronhopp ger ultraviolett ljus.

Bild: OskarUggla / UgglansNO
Varje grundämne har sina elektroner fördelade i skalen på ett unikt sätt. Eftersom elektronhoppen beror på denna fördelning kommer varje grundämne att sända ut ljus på ett unikt sätt. Ljuset undersöks i ett spektroskop. Där syns flera linjer med olika våglängder, likt ett fingeravtryck, som kallas linjespektrum.
Kunskapen kring spektrallinjer är viktigt inom astronomin. Genom att analysera elektromagnetisk strålning från himlakroppar med teleskop har mänskligheten fått bättre förståelse för universums uppbyggnad.
Bild: PontusWallstedt / UgglansNO
Fördjupning:
- Hemsida – Elektronhopp (studera.com)
- Film – Ljus och atomen (Bertram Stenlund, svenska, 2.38)
- Film – Spektrum(Bertram Stenlund, Bertram, 2,31)
- Film – Spectrum demo: Continuous and emission (Physics demos, engelska, 6.30)
Uppgifter:
| Hela kursen: | Kursens begrepp: | Kursens test: |
| Atomfysik | Quizlet – Tabs | Deltest – Stortest |
Hjälp till att förbättra Ugglans NO! Har du hittat något fel, någon död/olämplig länk eller vill tipsa om någon intressant länk? Skriv en kommentar nedan!


